生物体通过神经系统快速感知并响应环境变化,这一过程依赖于突触的精确信息传递。突触通过具有高度时空特异性的神经递质释放机制确保信息准确编码。该过程涉及突触小泡的锚定、成熟与膜融合三个阶段,使突触小泡与突触前膜相互融合,将其中的神经递质释放至突触间隙,并与突触后膜的相关受体结合,完成神经元间的信号传递。这一过程依赖于核心分子机器SNARE蛋白,Munc18-1及Munc13-1等关键调控因子。其中Munc13-1是多结构域蛋白,其作为突触囊泡成熟的核心调控因子促进SNARE复合物组装已被广泛研究,然而其功能活性的调控过程和机制尚不完全明确。
2025年6月9日,The Proceedings of the National Academy of Sciences(PNAS)在线发表了华中科技大学马聪教授课题组题为“A Specific Negatively Charged Sequence confers Intramolecular Regulation on Munc13-1 Function in Synaptic Exocytosis”的研究成果。该研究发现恒温动物的Munc13-1蛋白进化出具有响应钙离子功能的polyE结构域(图1),可通过分子内相互作用调控Munc13-1的自抑制构象,从而调控其活性。这一发现为理解Munc13-1的进化过程及神经突触可塑性的分子机制提供新视角。
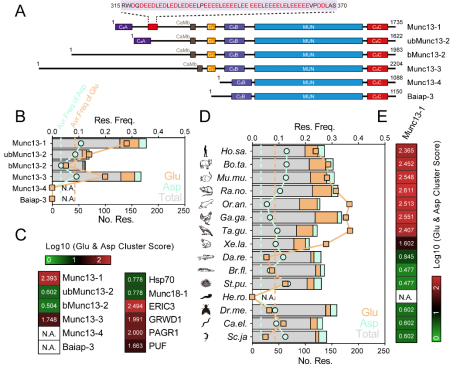
图1 Munc13-1 polyE结构域的鉴定及分析
研究中通过序列分析发现,恒温动物Munc13-1分子内靠近氨基末端的区域富集了大量谷氨酸及天冬氨酸等负电荷氨基酸,这一特征在两栖类动物(如爪蟾等)Munc13-1分子中已经开始存在少量的富集,而在其他Munc13亚型及低等生物中均不存在,暗示这一特征序列起源自两栖类生物,并在恒温动物中保留下来,可能在高等神经活动中发挥重要作用,将其命名为polyE结构域。实验发现polyE结构域通过分子内相互作用与Munc13-1的核心催化结构域MUN结合,并抑制Munc13-1催化SNARE复合物组装的活性,使Munc13-1处于自抑制构象。
进一步研究发现,polyE结构域与钙离子产生直接且特异的相互作用,暗示了其作为潜在的非经典钙离子感受器。单次动作电位产生的钙内流可将融合孔附近钙离子浓度提高至40 μM左右,通过单分子FRET技术证明,在相似的钙浓度条件下,可解除polyE对Munc13-1活性的抑制,从而启动SNARE的组装。另一方面,磷酸化是一种重要的蛋白翻译后修饰,在细胞信号转导和神经元活动中发挥关键作用。体外实验中引入模拟磷酸化突变可破坏polyE与MUN结构域的相互作用,并增强SNARE复合物的组装效率;细胞电生理实验表明,表达模拟磷酸化突变Munc13-1的神经元获得了更高的释放活性。以上结果说明,Munc13-1借助于polyE结构域通过钙离子和磷酸化双重机制调控活性(图2),以实现短期突触可塑性的形成。
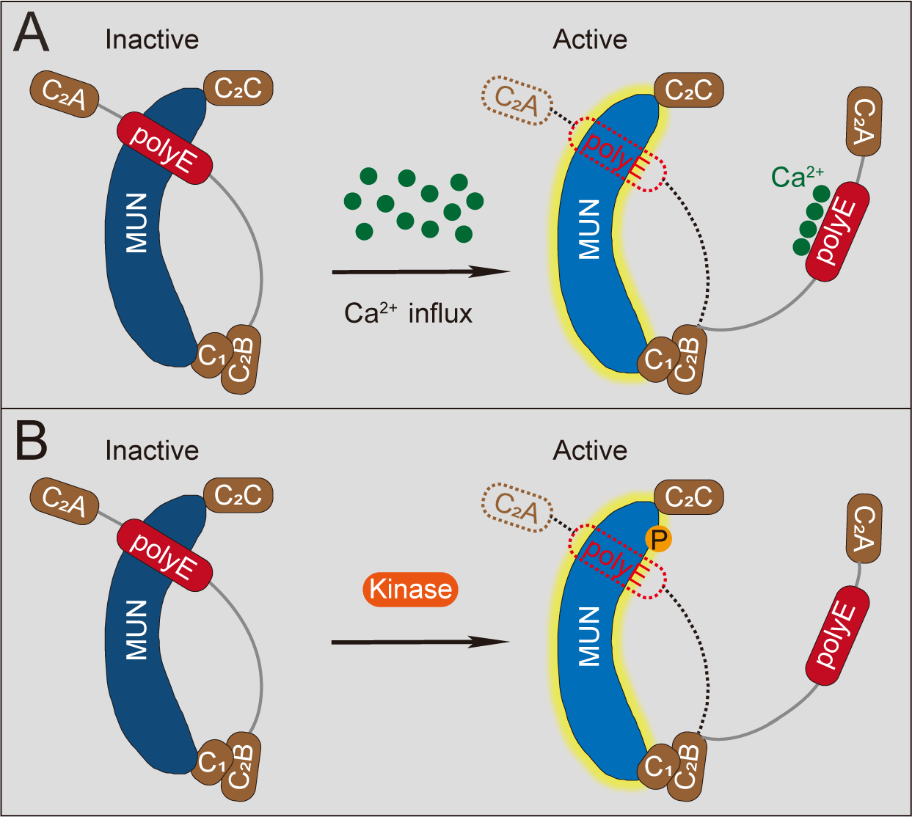
图2 Munc13-1借助于polyE结构域通过钙离子和磷酸化双重机制调控活性
综上所述,本研究发现并定义了Munc13-1中特异的polyE结构域,为理解Munc13-1的进化过程及神经突触可塑性的分子机制提供了新的见解。
华中科技大学yl23411永利集团官网博士赵可旭为本论文的第一作者,王申副研究员、马聪教授为共同通讯作者。研究还受到了香港城市大学胡志涛教授,以及华中科技大学人工智能与自动化学院盛银副教授的支持和参与。该研究受到了国家重点研发计划—科技创新2030“脑科学与类脑研究”重大项目、国家自然科学基金项目、湖北省自然科学基金、华中科技大学学科交叉研究计划项目资助。
原文链接:https://www.pnas.org/doi/10.1073/pnas.2508915122
https://pubmed.ncbi.nlm.nih.gov/40489622/