合生元是益生菌和益生元的组合,代表了一种结合活微生物及其底物的互补或协同策略,能给宿主带来健康益处。合生元通常被认为比单独的益生菌或益生元更有效,已被广泛报道为预防炎症性肠病(IBD)等微生物组相关疾病的安全方法。在体内,肠道微生物群作为一个整体对益生菌或益生元的影响做出集体反应。然而,目前的大多数研究都依赖于简化的体外细胞培养系统,研究单个益生菌或益生元的机制,从而无法复刻宿主复杂的生理环境,导致实验室发现难以转化为临床结果。因此,体内评估系统对于获得饮食-微生物-宿主相互作用的详细见解以及准确评估益生菌和益生元的功效仍然是不可或缺的。
2025年8月5日,华中科技大学yl23411永利集团官网陈卫华/刘智教授团队在国际顶尖期刊Gut Microbes上发表了题为In vivo systematic analysis of microbiota-prebiotic crosstalk reveals a synbiotic that effectively ameliorates DSS-induced colitis in mice的研究论文(论文链接:https://doi.org/10.1080/19490976.2025.2541028)。
在该研究中,研究团队使用多组学方法系统地研究了体内微生物群-益生元相互作用。构建了一个由健康人的代表性肠道核心微生物群和选定的益生菌组成的人工微生物群落(MC),并策划了一组可食用基质(ES),包括益生元和益生元候选物,以探索饮食、微生物和体内宿主免疫系统之间的相互作用,以及它们对宿主健康的影响。抗生素处理的小鼠进行MC定植,并喂食含有ES的饮食,揭示了移植MC对饮食ES的不同反应,其中14种ESs表现出对DSS诱导的小鼠肠道炎症的显著保护作用(图1)。
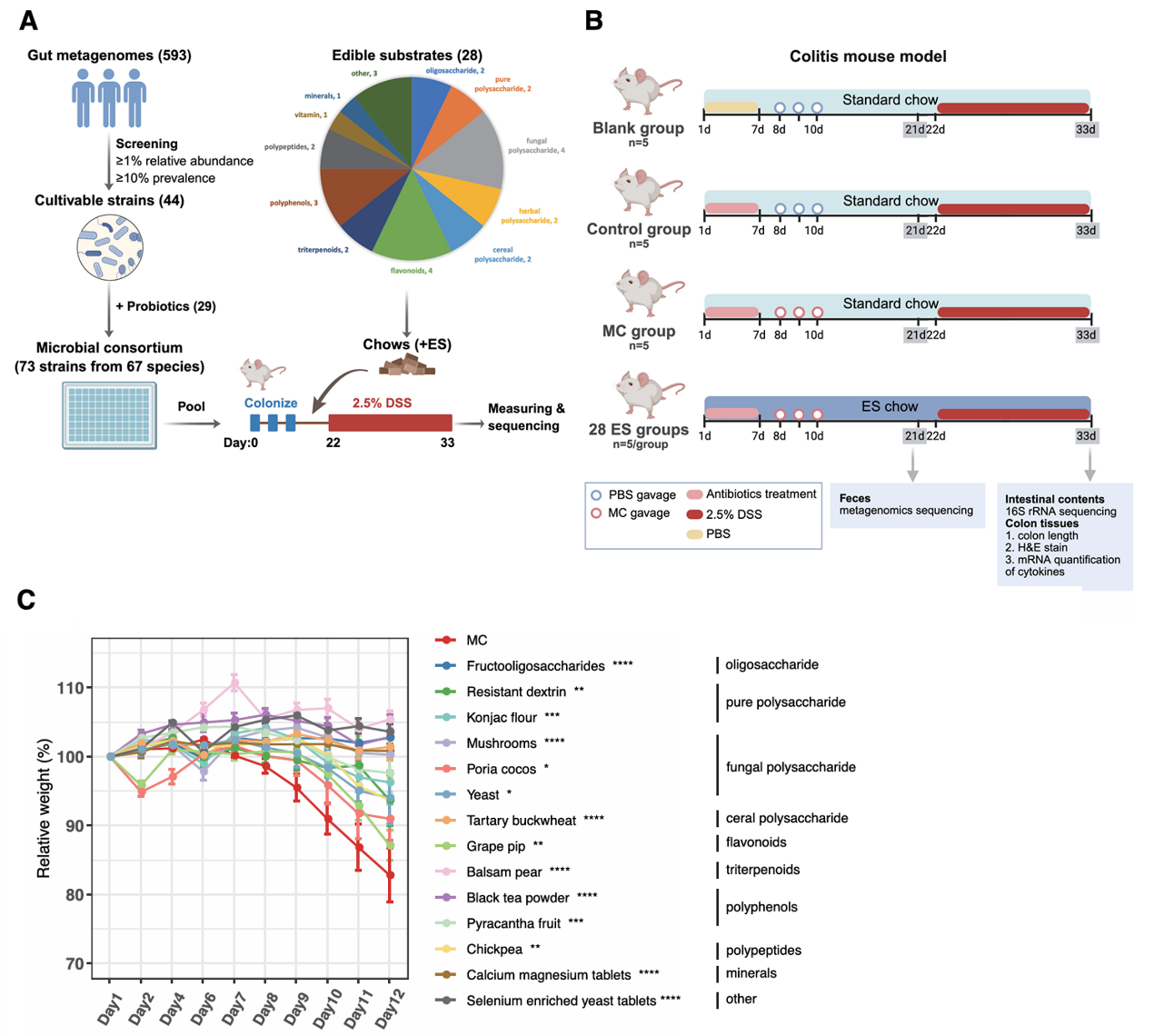
图1:MC与ES的组合对DSS诱导的小鼠结肠炎有显著保护作用
研究团队进一步确定了两种移植微生物,B. thetaiotaomicron 和 A. muciniphila在DSS诱导前被富集,能够抑制促炎细胞因子的表达并预防结肠炎,钙镁片(CMT)增强了它们的功效。然后通过测试这些微生物在体外和体内的生长和基因表达来验证这两种微生物和CMT的协同效应,支持这些组合方案在结肠炎治疗中的可行性。

图2:CMT增强B. thetaiotaomicron 和 A. muciniphila的功效
最后,研究团队在健康的人类志愿者中进行了干预试验,试验表明CMT选择性地增加了B. thetaiotaomicron的丰度,而不会导致整体肠道微生物组的显著变化。
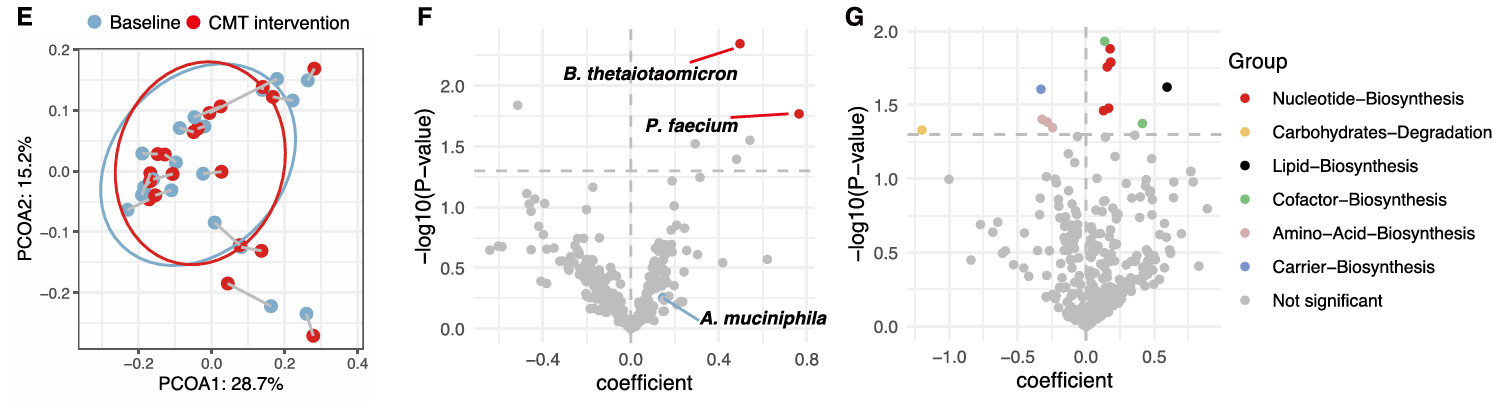
图3:CMT增加人体内B. thetaiotaomicron的丰度
综上所述,研究团队开发了一个合生元理性设计及功能验证的系统框架,用于阐明微生物-益生元相互作用,识别具有治疗潜力的合生元组合;并通过肠炎进行了合生元的体内功能验证,并初步证明了其人体适用的可能性,为基于微生物组的疾病预防和治疗策略提出新的方法及解决方案。
华中科技大学yl23411永利集团官网博士毕业生彭倩文、江浦滋和硕士毕业生易立文为论文的共同第一作者,华中科技大学的陈卫华教授、刘智教授和昆明医科大学第一附属医院的杨红菊主任医师为本文的通讯作者。本课题受到国家重点研发计划,云南省重点研发计划项目等经费资助。
近年来,陈卫华教授团队与刘智教授团队通力合作,以理工医交叉为导向,致力于肠道菌群与疾病关系研究。通过大数据解析疾病标志物,靶向分离肠道微生物资源,深入揭示益生菌应答宿主信号,参与宿主免疫、代谢调节的分子机制,并以此为基础指导对疾病的精准干预。近5年,双方共同完成研究者发起的临床研究(IIT)多项,相关成果以双方为通讯作者在《Cell Host & Microbe》、《Advanced Science》、《Microbiome》、《Nucleic Acids Research》、《ISME journal》、《Gut Microbes》等国际知名学术期刊上发表。