肿瘤细胞即使在氧供充足条件下,仍倾向于通过糖酵解途径获取能量并产生大量乳酸,这一现象被称为“瓦博格效应”(Warburg Effect)。高乳酸环境不仅促进肿瘤免疫逃逸和干细胞特性维持,还可通过乳酸化修饰调控多种细胞功能。然而,肿瘤源性乳酸对宿主全身代谢的影响,特别是乳酸对纳米药物体内过程的影响规律及作用机制,尚无系统研究。
针对这一问题,华中科技大学李子福教授、杨祥良教授揭示了肿瘤通过乳酸调控Kupffer细胞表型加速纳米药物Doxil清除的关键机制,并提出采用高压氧(Hyperbaric oxygen,HBO)治疗逆转该过程,显著增强纳米药物Doxil的抗肿瘤作用(图1)。HBO通过提高组织氧含量,激发“巴斯德效应”(Pasteur Effect)——即在氧气充足条件下,细胞优先进行有氧氧化并抑制糖酵解过程,从而系统降低肿瘤组织及机体乳酸,减少乳酸介导的组蛋白乳酸化修饰。因此,HBO调节Kupffer细胞提高M1型/M2型比例,降低其对于Doxil的清除能力,延长药物血液循环时间,促进药物在肿瘤中的富集与细胞摄取,最终增强化疗效果。
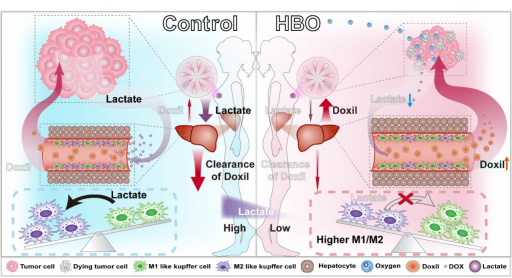
图1. 高压氧通过降低肿瘤诱导的乳酸水平,调节Kupffer细胞表型以增强Doxil疗效的示意图。
如图2所示,肿瘤负荷与乳酸水平及Doxil清除速率之间存在密切关联。与无肿瘤负荷患者相比,有肿瘤负荷患者的血清乳酸水平显著升高。小鼠模型进一步证实,肿瘤负荷与血液及肝脏中的乳酸浓度呈显著正相关。同时,荷瘤小鼠对Doxil的清除速率显著快于健康小鼠,且清除速率与肿瘤体积呈正相关。这一结果支持了肿瘤通过提升乳酸水平加速Doxil在肝脏中的清除的假设。
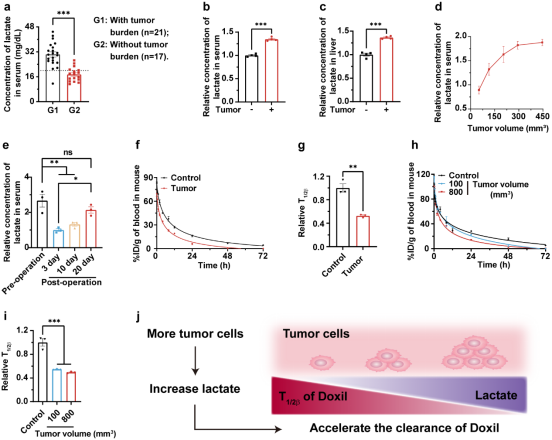
图2. 肿瘤诱导的乳酸加速Doxil清除
图3结果表明,HBO通过减少乳酸来延长Doxil的血液循环并增强肿瘤积聚。经HBO干预后,肿瘤小鼠的肿瘤组织、外周血液及肝脏中乳酸水平均下降约20%,Doxil的血浆半衰期显著延长,同时在肿瘤中的蓄积量增加。而外源补充乳酸可抵消HBO的上述效应,进一步证明肿瘤通过升高乳酸加速Doxil肝脏清除,且该过程可被HBO逆转。
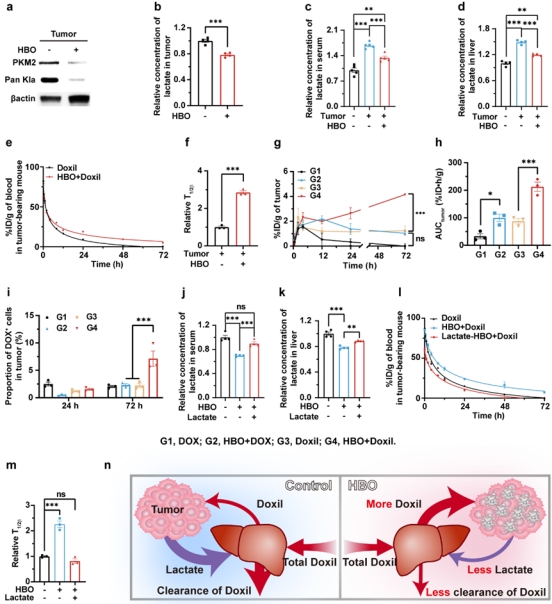
图3. HBO通过降低乳酸水平延长Doxil的血液循环并增强Doxil在肿瘤中积聚。
图4揭示肿瘤诱导的高乳酸水平对Kupffer细胞极化的调控作用。随着肿瘤体积增大,Kupffer细胞的M1/M2比值逐渐降低,400 mm³肿瘤组比50 mm³组降低36%。体外实验显示,乳酸浓度升高可导致巨噬细胞M1/M2比值降低和组蛋白乳酸化水平上升,表明肿瘤诱导的高乳酸通过组蛋白乳酰化抑制Kupffer细胞的M1极化并促进其M2极化。
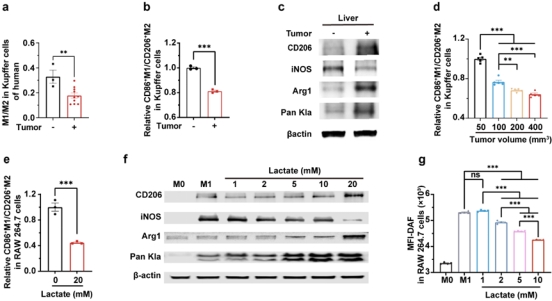
图4. 肿瘤诱导的高乳酸抑制Kupffer细胞的M1极化。
图5显示,HBO通过降低乳酸水平,逆转Kupffer细胞表型变化,从而延缓Doxil的清除。HBO治疗使Kupffer细胞M1/M2比值增加57%,肝内乳酸化水平降低,M1标志物iNOS增加,M2标志物CD206和Arg1减少。补充乳酸可逆转HBO对Kupffer细胞表型的调节作用。在使用TAK(M1极化抑制剂)处理后,HBO对Doxil清除的延缓效应消失,Doxil半衰期恢复至8.52小时。这些结果证明肿瘤通过乳酸抑制Kupffer细胞的M1极化并促进其M2极化,加快Doxil清除,HBO逆转这一过程。
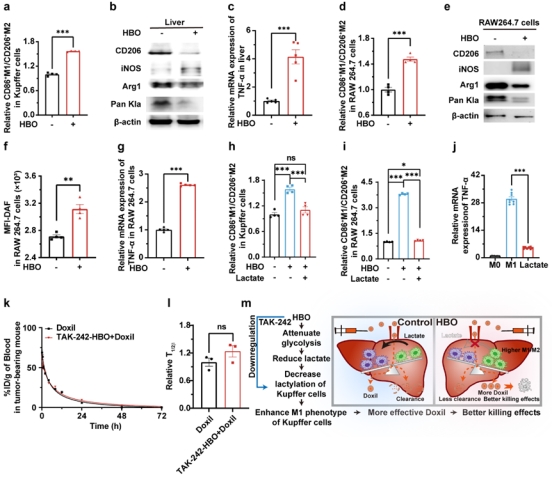
图5. HBO通过促进Kupffer细胞的M1型极化减少Doxil清除。
图6进一步验证HBO降低乳酸水平调节Kupffer细胞表型,从而增强Doxil的抗肿瘤效果。HBO与Doxil联用显著提高Doxil的抗肿瘤疗效并延长小鼠生存时间。补充乳酸后,逆转HBO对于Kupffer细胞M1/M2比值的提升,HBO对Doxil的增效作用消失,表明乳酸是HBO改善Doxil疗效的核心调控因子。
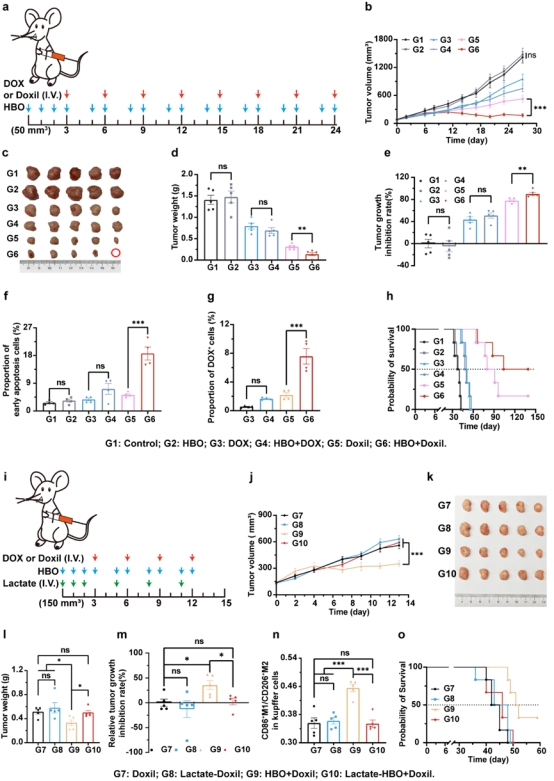
图6. HBO通过降低乳酸水平增强Doxil的抗肿瘤作用并延长小鼠生存期。
综上所述,该研究证明HBO通过降低乳酸水平、抑制糖酵解,减少肿瘤及正常组织中的乳酸生成。乳酸的减少削弱了Kupffer细胞向M2型的极化,增强其M1型极化,从而减少肝脏对Doxil的清除,延长Doxil血液循环时间,增加药物在肿瘤组织中的积累和细胞内化,最终显著增强Doxil的抗肿瘤效果。该研究成果以“Hyperbaric oxygen augments Doxil antitumor efficacy by reducing tumor-induced lactate”为题,于2025年9月3日发表在《Journal of Controlled Release》。本研究首次系统阐明乳酸在调控纳米药物递送过程的关键作用,对纳米载体的材料属性提出新要求。
华中科技大学博士生李世友、王幸和樊子涛为论文第一作者,李子福教授、杨祥良教授为论文通讯作者,华中科技大学附属协和医院肿瘤中心赵艳霞副主任、中山大学陈柏竹副教授参与了此项工作。
文章链接:https://doi.org/10.1016/j.jconrel.2025.114181